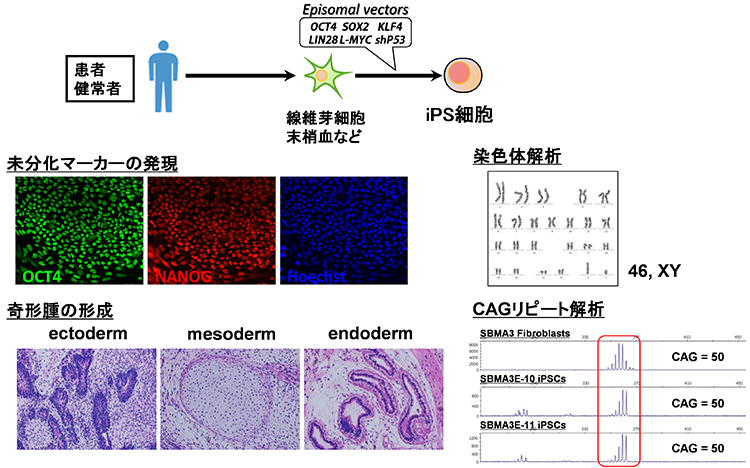
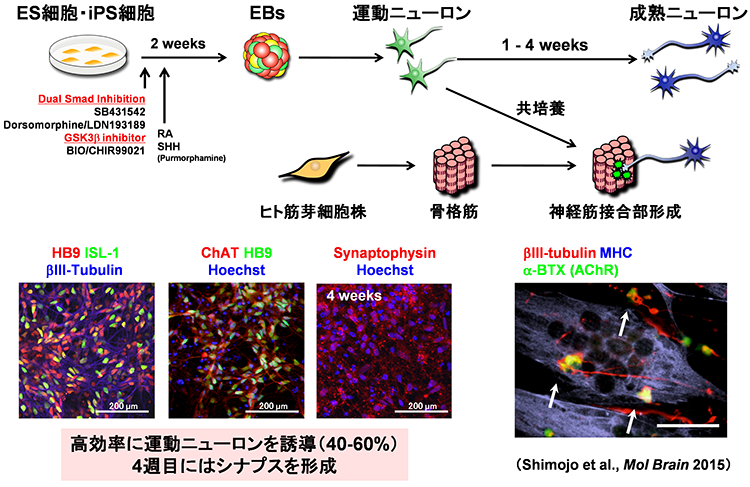
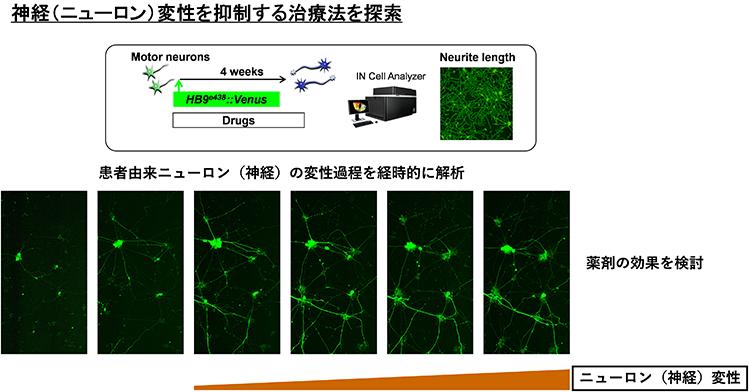
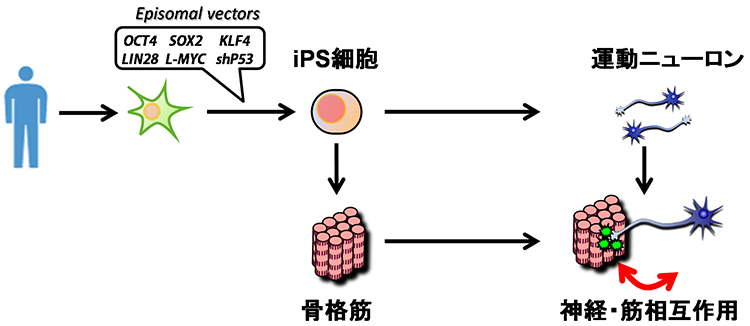
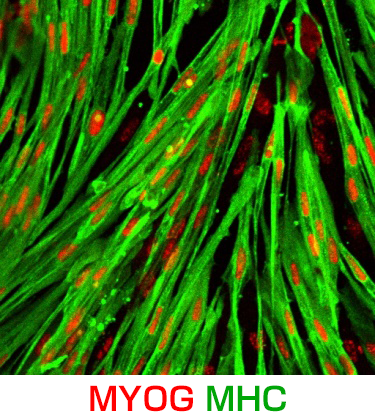
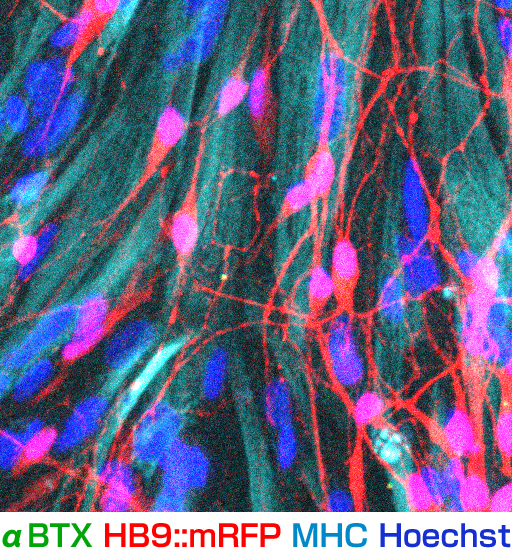
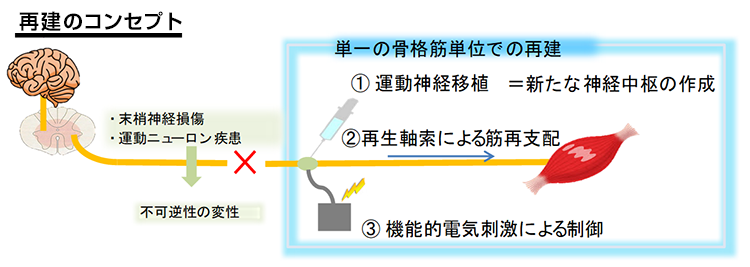
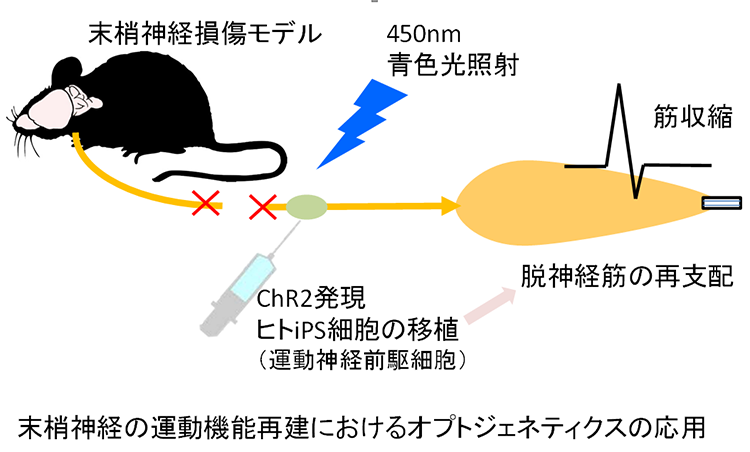
01様々な神経変性疾患の病態には、異常タンパクの蓄積と凝集体形成が関与
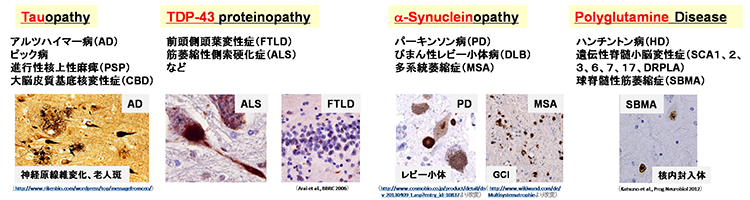
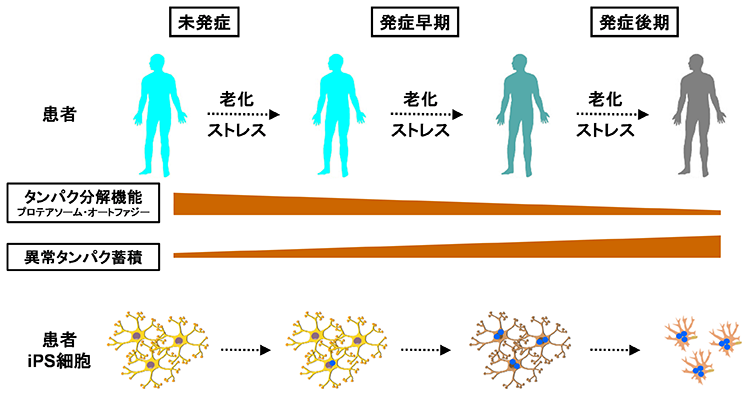
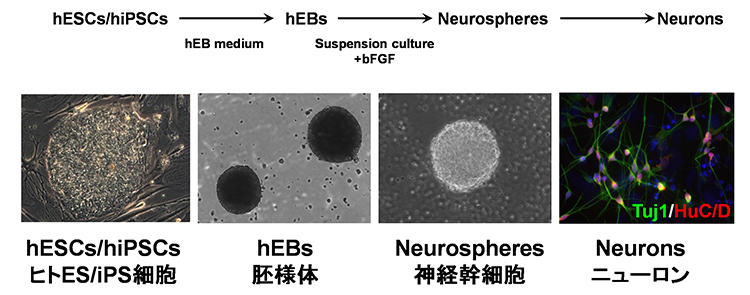
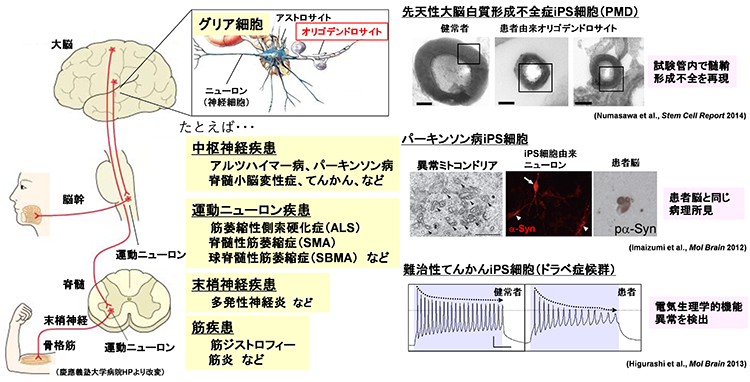
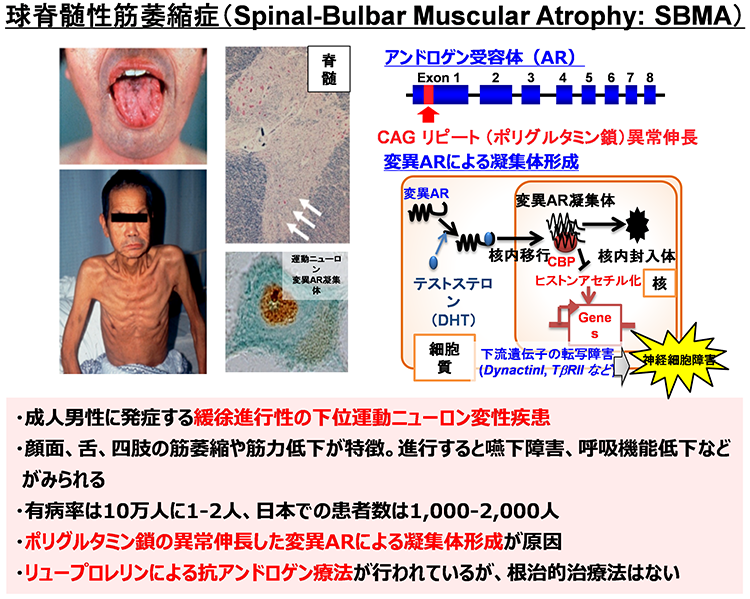
多くの神経変性疾患では、病理学的な解析により、神経組織における異常タンパク質の蓄積が示されてきました。これらの異常タンパク質は、老化や様々なストレスにより凝集体を形成し、神経変性をもたらすと考えられてきました。また、このような異常タンパク質の蓄積を標的とした治療法の開発が数多く試みられてきました。しかし、これまでの様々な知見から、異常タンパク質の蓄積だけでは神経変性の病態を説明しきれないことから、神経変性疾患克服のためには、異常タンパク質の蓄積に依存しない病態(早期病態)を明らかにする必要があると考えられます。剖検によって得られる死後の病理検体は、病気の原因を探るためのきわめて重要な検体で、神経変性が起こった後の状態の観察には非常に有用ですが、疾患の発症機構や神経変性過程の解析には適していません。したがって、神経変性疾患の病態の本質を解明するためには、「疾患がまさに起こっている状態を再現できる疾患モデル」を用いた解析が重要であると考えています。そしてそれがまさにiPS細胞を用いた疾患モデルであると考えています。